
Sự chuyển dịch cân bằng hóa học là gì?
Cân bằng hóa học - một khái niệm tưởng chừng đơn giản nhưng ẩn chứa nhiều điều kỳ thú. Sự chuyển dịch cân bằng chính là chìa khóa để giải mã những bí ẩn đó. Bài viết này, yeuhoahoc.edu.vn sẽ dẫn dắt bạn khám phá thế giới đầy biến đổi của cân bằng hóa học, từ nguyên nhân dẫn đến sự thay đổi trạng thái cân bằng đến các yếu tố ảnh hưởng và ứng dụng thực tế của nó. Hãy cùng bước vào hành trình chinh phục kiến thức hóa học đầy hấp dẫn này!
Sự chuyển dịch cân bằng hóa học là gì?
Giải thích
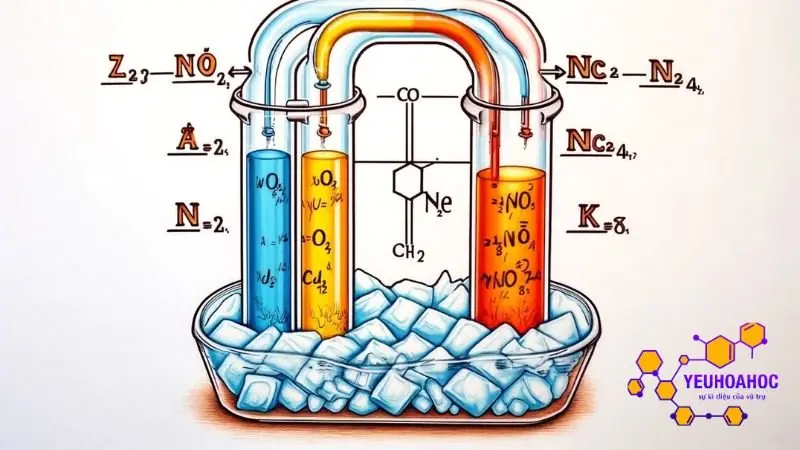
Cân bằng hóa học là tình trạng trong đó tốc độ của phản ứng thuận và phản ứng nghịch cân bằng nhau, làm cho nồng độ của các chất phản ứng và sản phẩm giữ nguyên không thay đổi theo thời gian. Tuy nhiên, trạng thái này không cố định mà có thể thay đổi khi chịu tác động từ các yếu tố bên ngoài.
Sự chuyển dịch cân bằng hóa học là hiện tượng trạng thái cân bằng của một phản ứng thuận nghịch bị phá vỡ do tác động của các yếu tố bên ngoài, dẫn đến nồng độ các chất tham gia và sản phẩm thay đổi cho đến khi đạt được trạng thái cân bằng mới.
Ví dụ:
Phản ứng tổng hợp amoniac: N2 + 3H2 → 2NH3 (phản ứng thu nhiệt) Trạng thái cân bằng: Nồng độ N2, H2 và NH3 đạt một giá trị nhất định. Tác động: Nhúng bình phản ứng vào nước đá (giảm nhiệt độ). Chuyển dịch: Cân bằng chuyển dịch theo chiều nghịch (tạo ra N2 và H2, giảm NH3) để tỏa nhiệt và chống lại tác động của việc giảm nhiệt độ.
Ý nghĩa
Sự chuyển dịch cân bằng hóa học có vai trò quan trọng trong nhiều lĩnh vực:
- Sản xuất hóa chất: Điều chỉnh điều kiện phản ứng để thu được sản phẩm mong muốn với hiệu suất cao.
- Cân bằng sinh học: Duy trì các quá trình trao đổi chất trong cơ thể sinh vật.
- Bảo vệ môi trường: Xử lý ô nhiễm môi trường bằng cách chuyển dịch cân bằng của các phản ứng có hại.
Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học
Nhiệt độ
Tăng nhiệt độ: Cân bằng chuyển dịch theo chiều ngược lại với chiều phản ứng thu nhiệt. Lý do:
Phản ứng thu nhiệt hấp thụ nhiệt, làm giảm tác động của việc tăng nhiệt độ, do đó cân bằng chuyển dịch theo chiều nghịch để chống lại sự thay đổi này.
Ví dụ: Phản ứng tổng hợp amoniac (thu nhiệt), khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch, giảm lượng amoniac tạo ra.
Giảm nhiệt độ: Cân bằng chuyển dịch theo chiều thuận với chiều phản ứng tỏa nhiệt. Lý do:
Phản ứng tỏa nhiệt giải phóng nhiệt, làm tăng tác động của việc giảm nhiệt độ, do đó cân bằng chuyển dịch theo chiều thuận để chống lại sự thay đổi này.
Ví dụ: Phản ứng phân hủy canxi cacbonat (tỏa nhiệt), khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều thuận, tăng lượng canxi cacbonat phân hủy.
Nồng độ
Tăng nồng độ chất tham gia: Cân bằng chuyển dịch theo chiều thuận với chiều phản ứng tiêu thụ chất tham gia đó. Lý do:
- Theo nguyên lý Le Chatelier, khi tăng nồng độ chất tham gia, hệ phản ứng sẽ tăng tốc độ phản ứng thuận để giảm bớt lượng chất tham gia dư thừa.
Phản ứng tổng hợp amoniac: N2 + 3H2 → 2NH3 (phản ứng thu nhiệt)
Trạng thái cân bằng: Nồng độ N2, H2 và NH3 đạt một giá trị nhất định.
Tác động: Nhúng bình phản ứng vào nước đá (giảm nhiệt độ).
Chuyển dịch: Cân bằng chuyển dịch theo chiều nghịch (tạo ra N2 và H2, giảm NH3) để tỏa nhiệt và chống lại tác động của việc giảm nhiệt độ.
Giảm nồng độ chất tham gia: Cân bằng chuyển dịch theo chiều nghịch với chiều phản ứng tạo thành chất tham gia đó. Lý do:
- Theo nguyên lý Le Chatelier, khi giảm nồng độ chất tham gia, hệ phản ứng sẽ tăng tốc độ phản ứng nghịch để bù đắp lượng chất tham gia thiếu hụt.
- Ví dụ: Phản ứng phân hủy nước (H2O → H2 + O2), khi giảm nồng độ H2O, cân bằng chuyển dịch theo chiều nghịch, phân hủy nước ít hơn, tạo ra nhiều H2 và O2 hơn.
Tăng nồng độ sản phẩm: Cân bằng chuyển dịch theo chiều nghịch với chiều phản ứng tạo thành sản phẩm đó. Lý do:
- Theo nguyên lý Le Chatelier, khi tăng nồng độ sản phẩm, hệ phản ứng sẽ tăng tốc độ phản ứng nghịch để giảm bớt lượng sản phẩm dư thừa.
- Ví dụ: Phản ứng tổng hợp amoniac (N2 + 3H2 → 2NH3), khi tăng nồng độ NH3, cân bằng chuyển dịch theo chiều nghịch, giảm lượng amoniac tạo ra.
Giảm nồng độ sản phẩm: Cân bằng chuyển dịch theo chiều thuận với chiều phản ứng tiêu thụ sản phẩm đó. Lý do:
- Theo nguyên lý Le Chatelier, khi giảm nồng độ sản phẩm, hệ phản ứng sẽ tăng tốc độ phản ứng thuận để bù đắp lượng sản phẩm thiếu hụt.
- Ví dụ: Phản ứng phân hủy canxi cacbonat (CaCO3 → CaO + CO2), khi giảm nồng độ CO2, cân bằng chuyển dịch theo chiều thuận, phân hủy CaCO3 nhiều hơn, tạo ra nhiều CaO và CO2 hơn.
Áp suất
Đối với phản ứng có chất khí tham gia, việc thay đổi áp suất sẽ ảnh hưởng đến chiều chuyển dịch cân bằng theo nguyên tắc Le Chatelier:
- Nâng cao áp suất: Cân bằng dịch chuyển theo hướng giảm lượng mol khí.
- Hạ thấp áp suất: Cân bằng dịch chuyển theo hướng tăng lượng mol khí.
Lý giải:
- Áp suất được định nghĩa là lực tác động lên một đơn vị diện tích. Khi tăng áp suất, các phân tử khí va chạm nhau nhiều hơn, dẫn đến tăng khả năng xảy ra phản ứng theo chiều làm giảm số mol khí (phản ứng nghịch). Ngược lại, khi giảm áp suất, khoảng cách giữa các phân tử khí tăng lên, dẫn đến giảm khả năng xảy ra phản ứng theo chiều làm giảm số mol khí, do đó cân bằng chuyển dịch theo chiều làm tăng số mol khí (phản ứng thuận).
Ví dụ:
- Phản ứng tổng hợp amoniac: N2 + 3H2 → 2NH3 (phản ứng có 4 mol khí tham gia và 2 mol khí sản phẩm)
- Tăng áp suất: Cân bằng chuyển dịch theo chiều nghịch (tạo N2 và H2, giảm NH3).
- Giảm áp suất: Cân bằng chuyển dịch theo chiều thuận (tạo NH3, giảm N2 và H2).
Chất xúc tác
Chất xúc tác không ảnh hưởng đến vị trí cân bằng của phản ứng hóa học. Tuy nhiên, nó tăng tốc độ phản ứng theo chiều thuận và nghịch với tỷ lệ như nhau. Do đó, chất xúc tác giúp hệ phản ứng đạt đến trạng thái cân bằng nhanh hơn.
Giải thích:
- Chất xúc tác làm giảm năng lượng kích hoạt của phản ứng, giúp các phân tử dễ dàng vượt qua rào cản năng lượng và tham gia phản ứng hơn.
- Khi tốc độ phản ứng tăng, nồng độ các chất tham gia và sản phẩm thay đổi nhanh hơn, dẫn đến việc hệ phản ứng đạt được trạng thái cân bằng mới nhanh hơn.
Nguyên lý Le Chatelier
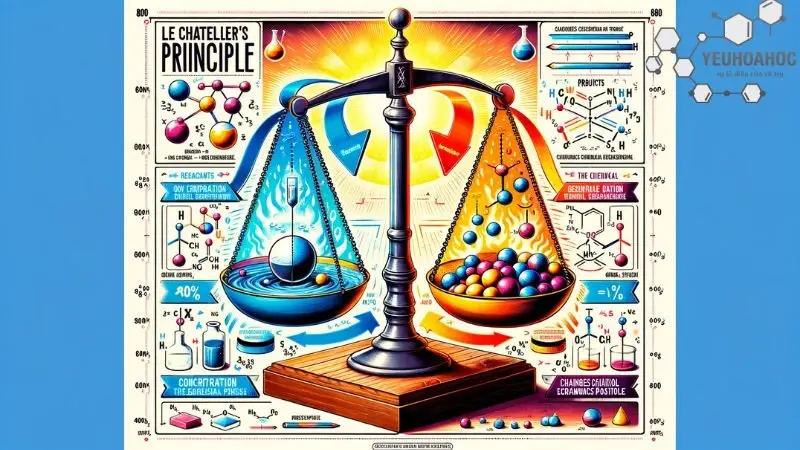
Giới thiệu:
Nguyên lý Le Chatelier, còn được gọi là nguyên lý chuyển dịch cân bằng, được đưa ra bởi nhà hóa học người Pháp Henri Louis Le Chatelier vào năm 1884. Nguyên lý này mô tả mối quan hệ giữa sự thay đổi các yếu tố bên ngoài (nhiệt độ, áp suất, nồng độ) và sự chuyển dịch cân bằng của một phản ứng hóa học thuận nghịch.
Nội dung:
- Khi một hệ thống đang ở trạng thái cân bằng, nếu chịu tác động từ bên ngoài (nhiệt độ, áp suất, nồng độ) thì hệ thống sẽ tự điều chỉnh theo chiều làm giảm tác động của sự thay đổi đó.
Vận dụng nguyên lý Le Chatelier:
Để dự đoán chiều chuyển dịch cân bằng khi có thay đổi các yếu tố ảnh hưởng, ta cần thực hiện các bước sau:
- Xác định chiều thuận và chiều nghịch của phản ứng.
- Xác định yếu tố thay đổi (nhiệt độ, áp suất, nồng độ).
- Phân tích ảnh hưởng của yếu tố thay đổi đến chiều thuận và chiều nghịch theo nguyên tắc Le Chatelier.
- Dựa trên phân tích, dự đoán chiều chuyển dịch cân bằng.
Ví dụ minh họa:
Ví dụ 1:
- Phản ứng tổng hợp amoniac: N2 + 3H2 → 2NH3 (phản ứng thu nhiệt)
- Trạng thái cân bằng: Nồng độ N2, H2 và NH3 đạt một giá trị nhất định.
- Tác động: Nhúng bình phản ứng vào nước đá (giảm nhiệt độ).
- Phân tích: Phản ứng thu nhiệt, giảm nhiệt độ làm tăng tác động của chiều nghịch (tạo N2 và H2, giảm NH3).
- Dự đoán: Cân bằng chuyển dịch theo chiều nghịch (tạo N2 và H2, giảm NH3).
Ví dụ 2:
- Phản ứng phân hủy canxi cacbonat: CaCO3 → CaO + CO2 (phản ứng thu nhiệt)
- Trạng thái cân bằng: Nồng độ CaCO3, CaO và CO2 đạt một giá trị nhất định.
- Tác động: Thêm CaO vào bình phản ứng.
- Phân tích: Nồng độ CaO tăng, làm tăng tác động của chiều nghịch (tạo CaCO3 và CO2, giảm CaO).
- Dự đoán: Cân bằng chuyển dịch theo chiều nghịch (tạo CaCO3 và CO2, giảm CaO).
Áp dụng sự chuyển dịch cân bằng hóa học
Ví dụ ứng dụng
- Sản xuất amoniac:
- Phản ứng: N2 + 3H2 → 2NH3 (phản ứng thu nhiệt, có 4 mol khí tham gia và 2 mol khí sản phẩm)
- Điều kiện: Áp suất cao, nhiệt độ vừa phải (khoảng 450°C), có chất xúc tác.
- Giải thích:
- Áp suất cao giúp tăng số mol khí tham gia, làm tăng tốc độ phản ứng thuận (tạo NH3).
- Nhiệt độ vừa phải giúp cân bằng đạt được ở hiệu suất cao.
- Chất xúc tác giúp tăng tốc độ phản ứng, đẩy nhanh quá trình đạt trạng thái cân bằng.
- Lợi ích: Tăng hiệu suất sản xuất amoniac, tiết kiệm năng lượng.
- Điều chế axit sunfuric:
- Phản ứng: 2SO2 + O2 ⇌ 2SO3 (phản ứng tỏa nhiệt)
- Điều kiện: Nhiệt độ cao (khoảng 800°C), có chất xúc tác.
- Giải thích:
- Nhiệt độ cao giúp tăng tốc độ phản ứng thuận (tạo SO3).
- Chất xúc tác giúp tăng tốc độ phản ứng, đẩy nhanh quá trình đạt trạng thái cân bằng.
- Lợi ích: Tăng hiệu suất sản xuất axit sunfuric, giảm chi phí sản xuất.
- Sản xuất etanol:
- Phản ứng: C6H12O6 → 2C2H5OH + 2CO2 (phản ứng thu nhiệt, có chất xúc tác sinh học là men rượu)
- Điều kiện: Nhiệt độ phòng (khoảng 30°C), pH thích hợp, có men rượu.
- Giải thích:
- Nhiệt độ phòng giúp tạo điều kiện cho men rượu hoạt động hiệu quả.
- pH thích hợp giúp duy trì hoạt động của men rượu.
- Men rượu là chất xúc tác sinh học giúp tăng tốc độ phản ứng, đẩy nhanh quá trình lên men rượu.
- Lợi ích: Tăng hiệu suất sản xuất etanol, giảm chi phí sản xuất.
Lợi ích
- Tăng hiệu suất phản ứng: Áp dụng sự chuyển dịch cân bằng hóa học giúp điều chỉnh điều kiện phản ứng để thu được sản phẩm mong muốn với hiệu suất cao hơn.
- Tiết kiệm năng lượng: Điều chỉnh điều kiện phản ứng phù hợp giúp giảm tiêu hao năng lượng, góp phần bảo vệ môi trường.
- Thay đổi sản phẩm: Áp dụng sự chuyển dịch cân bằng hóa học giúp thay đổi hướng của phản ứng, tạo ra sản phẩm mong muốn.
- Kiểm soát ô nhiễm môi trường: Áp dụng sự chuyển dịch cân bằng hóa học giúp xử lý các chất ô nhiễm trong môi trường bằng cách chuyển dịch cân bằng theo chiều có lợi cho việc phân hủy các chất ô nhiễm.
Sự chuyển dịch cân bằng hóa học không chỉ là một khái niệm lý thuyết đơn thuần mà còn có tầm quan trọng to lớn trong thực tế. Hiểu rõ nguyên tắc này giúp ta tối ưu hóa các quá trình sản xuất, điều chế hóa chất, đồng thời góp phần giải quyết các vấn đề môi trường. Hãy nắm vững kiến thức về sự chuyển dịch cân bằng hóa học để mở ra cánh cửa tiềm năng trong học tập, nghiên cứu và ứng dụng hóa học!
Link nội dung: https://study-japan.edu.vn/su-chuyen-dich-can-bang-hoa-hoc-la-gi-a16288.html